喜訊 | 任若冰教授課題組揭示鞘氨醇-1-磷酸受體S1PR1激活的分子機制
2022年4月11日,香港中文大學(深圳)醫(yī)學院|生命與健康科學學院客座助理教授(復旦大學代謝與整合生物學研究院研究員)任若冰、中國科學院分子細胞科學卓越創(chuàng)新中心汪勝研究員和香港中文大學(深圳)助理教授竺立哲合作在國際著名學術期刊《美國國家科學院院刊》(《The Proceedings of the National Academy of Sciences》)在線發(fā)表了“Structural Insights into Sphingosine-1-phosphate Receptor Activation”的研究成果。任若冰課題組博士后玉蕾葉、博士生甘冰、汪勝課題組博士生賀莉聰、竺立哲課題組博士生題如涓為本文共同第一作者,香港中文大學(深圳)為第一單位。
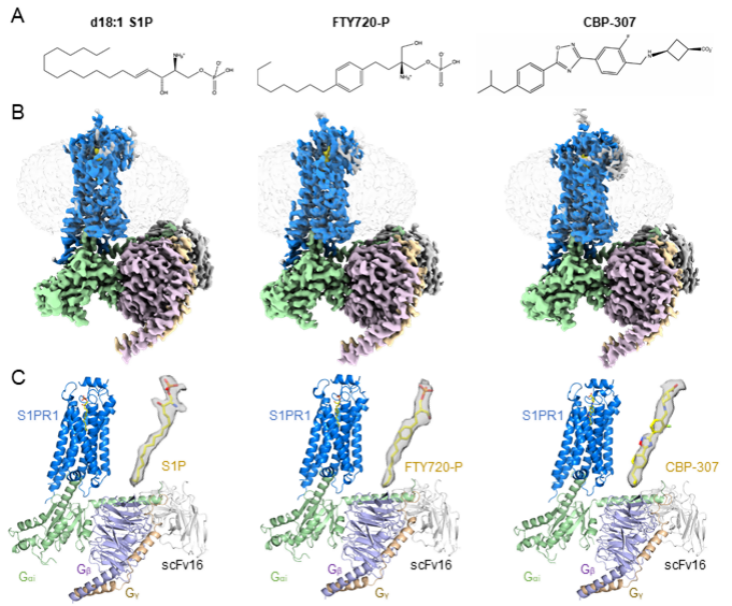
人源S1PR1結(jié)合三種激動劑小分子的高分辨率復合體的結(jié)構(gòu)
(點擊圖片,閱讀全文)
鞘氨醇-1-磷酸(Sphingosine-1-phosphate, S1P)是高等生物中高度保守的活性鞘脂類代謝物,調(diào)節(jié)多種細胞過程,如介導淋巴細胞遷移、保持血管的完整性以及產(chǎn)生細胞因子和趨化因子等,對免疫和心血管系統(tǒng)具有重要的作用。S1P信號異常會導致心血管疾病、代謝綜合征、自免疫失調(diào)、癌癥和腎病等多種疾病[1]。
S1P通過結(jié)合不同的S1P受體亞型(S1PR1-5)激活下游信號通路。S1P的5個受體都屬于G蛋白結(jié)合的受體A類家族。其中,S1PR1由于能夠調(diào)節(jié)T細胞和B細胞的遷移,受到更廣泛的關注和研究,已經(jīng)成為重要的藥物開發(fā)靶標蛋白。FTY720-P是最早被開發(fā)用于治療多發(fā)性硬化癥的藥物小分子[2],而小分子CBP-307已經(jīng)用于治療潰瘍性結(jié)腸炎和克羅恩病的臨床研究[3]。然而,由于缺少結(jié)構(gòu)的研究,CBP-307與受體的結(jié)合和激活受體的機制仍不夠清楚。此外,目前已知的S1PR1激動劑大多存在特異性不高的問題,研究不同S1PR1激動劑小分子和S1PR1的結(jié)構(gòu)及相互作用,有助于開發(fā)高特異性的靶向S1PR1的藥物小分子。
該研究對S1P、FTY720-P和CBP-307結(jié)合識別S1PR1的關鍵位點、激活機制以及關鍵配體結(jié)合位點對不同激動劑介導的下游信號轉(zhuǎn)導的影響進行了詳細的闡釋。主要包括:(1)S1P和FTY720-P具有相似的結(jié)合S1PR1的模式。兩個近乎伸展的分子結(jié)合在S1PR1相同的長的頂部親水底部疏水的配體結(jié)合口袋。突變體的功能實驗發(fā)現(xiàn)配體結(jié)合口袋中的E1213.29、R1203.28和N1012.60三個位點是影響S1P和FTY720-P介導的Gi結(jié)合與解離的關鍵位點。另外,配體結(jié)合口袋頂部極性氨基酸對于穩(wěn)定S1P的頭部和激活下游Gi信號起到了重要的作用。相比于S1P,配體結(jié)合口袋的其它氨基酸位點的突變對于FTY720-P介導的Gi信號影響更小。(2)與非激活態(tài)的結(jié)構(gòu)比較顯示,S1P激活S1PR1是通過誘導配體結(jié)合口袋底部F2105.47和W2696.48等疏水的重要氨基酸的構(gòu)象的改變,從而引發(fā)相關跨膜螺旋的構(gòu)象變化以及進一步和Gi的結(jié)合。(3)和S1P以及FTY720-P相似,CBP-307小分子也是結(jié)合在S1PR1的配體口袋,與口袋頂部的極性氨基酸和底部的疏水氨基酸相互作用。不同的是,F(xiàn)125A的突變更顯著的影響了CBP-307介導的Gi結(jié)合的信號。有趣的是,CBP-307分子被發(fā)現(xiàn)存在兩種結(jié)合在配體口袋的模式:深結(jié)合和淺結(jié)合。結(jié)構(gòu)分析顯示,CBP-307深結(jié)合模式和周圍氨基酸相互作用更強,分子動力學模擬也進一步證實了結(jié)構(gòu)的分析。本項研究工作首次發(fā)現(xiàn)CBP-307的兩種結(jié)合模式的復合體結(jié)構(gòu)中,Gi的N端螺旋存在5度的旋轉(zhuǎn)。CBP-307深結(jié)合模式結(jié)構(gòu)中的Gi的N端螺旋處于更靠近膜的位置,可能有利于穩(wěn)定復合體。此外,CBP-307激活S1PR1的機制和S1P相似, CBP-307先結(jié)合到口袋較淺的位置激活S1PR1,然后,進一步深入結(jié)合到口袋內(nèi)部,進一步的穩(wěn)定激活態(tài)的復合體。(4)兩個空的亞口袋被發(fā)現(xiàn)存在于S1P結(jié)合的S1PR1結(jié)構(gòu)中,其中一個在其它3個解析的結(jié)構(gòu)中也沒被占據(jù)。這將有助于開發(fā)更高選擇性和特異性的S1PR1的激動劑。
綜上,本項研究利用冷凍電鏡單顆粒三維重構(gòu)技術揭示了S1PR1天然配體激動劑S1P和藥物小分子FTY720-P(Fingolimod-P,磷酸化的芬戈莫德)和CBP-307分別結(jié)合并激活S1PR1的分子機制,為開發(fā)具有更高選擇性和高效性的靶向S1PR的藥物小分子及相關疾病的治療提供了重要的參考依據(jù)。
?
參考文獻:
1.Ren RB, Pang B, Han YF, Li YH. A Glimpse of Structural Biology on Sphingosine-1-Phosphate Metabolism. Contact, 2021, 4: 2515256421995601.
2.Strader, C.R., Pearce, C.J. & Oberlies, N.H. Fingolimod (FTY720): A Recently Approved Multiple Sclerosis Drug Based on a Fungal Secondary Metabolite. Journal of Natural Products 74, 900-907 (2011).
3.https://www.connectbiopharm.com/pipeline/cbp-307/
?
文章轉(zhuǎn)自醫(yī)學院生命健康學院微信公眾平臺,鏈接為https://mp.weixin.qq.com/s/1N2CssfGUbexbXF1x8w7vA





